
では実際、薬ができるまでにはどのようなプロセスがあるのでしょうか?
| 基礎研究 | 2~3年 | 自然界の中から、未知の物質や、 治療に効果のありそうな物質を探します。 |
|
|---|---|---|---|
| 5~50億円 | |||
| 非臨床試験 | 3~5年 | 基礎研究で見つかった物質の効果、安全性などを、 動物を使って研究します。 |
|
| 20~100億円 | |||
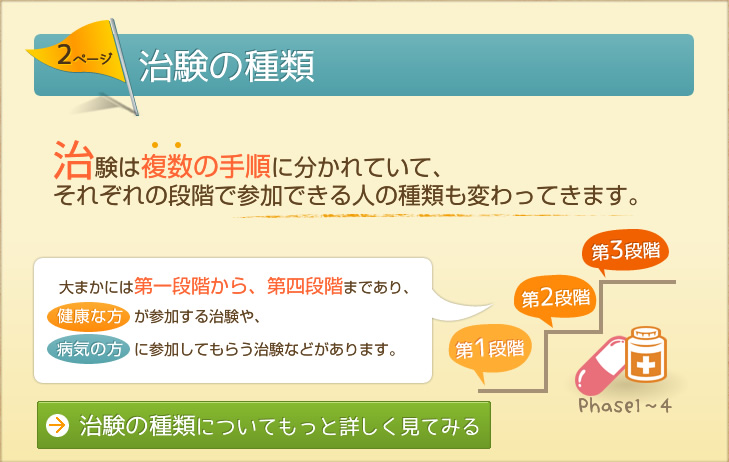
| 臨床試験(治験) | 3~7年 | フェイズ1 | 主に健康な成人男性に投与する試験です。 体内での吸収・代謝・排泄を調べます。 |
| フェイズ2 | 少数の患者さんを対象に効果・安全性を調べる テストです。 最も効果的な用法・用量を調べます |
||
| 20~100億円 | フェイズ3 | 実際の治療に近い方法で、大勢の患者さんを対象に
薬の効果と安全性を調べます。 同じ効果のある市販の薬や、プラセボ(偽薬)の比較試験も行います。 |
|
| 厚生労働省での承認審査 | 2~3年 | 以上の結果をもとに、 厚生労働省の中央薬事審議会で審査します |
|
| 5~20億円 | |||
| 発売 | - | 新薬の誕生です。 | |
| - | |||
| 製造販売後臨床試験 | - | フェイズ4 | 市販された後も、試験や調査をします。治験の時に得られなかった 情報(有効性や安全性)、新たな治療法、副作用に関する情報を収集します。 |
| - | |||
| 製造販売後調査 | 6年 | ||
| 30~50億円 | |||
以上のようなプロセスを踏みます。その中の一部に治験があります。
今まで治験に参加した経験のある人、あるいは今から参加する予定の人は、自分の参加する治験が
いったいどの場所にあたるのか、調べてみましょう。
ちなみに販売された薬は、販売後も安全性の試験や調査があります。 ドラッグストアで売っていた薬が店から消えてしまったとすれば、販売後の調査や試験で販売停止とされたからかもしれません。

それでは大まかなプロセスの流れを見てみましょう。
 |
製薬会社が、治験実施施設(病院など)に依頼をします。 |
|---|---|
 |
医師や薬剤師、弁護士、学者、一般人などのメンバーで |
 |
院内などに組織した審査委員会でOKが出たら、 |
 |
治験実施施設(病院など)は、 |
 |
治験を担当する医師と治験コーディネーター(CRC)、治験を手伝う看護師、 |
 |
治験実施施設(病院など)でスタートします。 |
 |
医師や治験コーディネーター(CRC)が、 |
 |
スケジュールに沿って、参加者に対し健康診断、各種の検査を行います。 |
 |
事前の健康診断、各種の検査に問題がなければ、治験薬の投与を行います。 |
 |
治験が正しく行なわれているか、製薬会社がチェックします。 |
 |
治験を担当する医師が報告書を書き、製薬会社に出します。 |
 |
製薬会社は、治験の実施状況をモニタリングし、医師から提出された報告書をチェックします。 |
 |
治験の責任医師は、治験終了報告書を治験審査委員会へ提出します。 |
 |
時期をずらして、フェイズ2、フェイズ3の治験を行ないます。 |














13/08/09
13/07/24
13/07/22